Diferencia entre revisiones de «Problemas de introducción a la termodinámica (GIOI)»
Secciones
| (No se muestran 26 ediciones intermedias del mismo usuario) | |||
| Línea 35: | Línea 35: | ||
[[Dilatación de una esfera metálica|Solución]] | [[Dilatación de una esfera metálica|Solución]] | ||
==Dilatación de raíles== | |||
Los raíles ferroviarios son de acero y tienen 18 m de longitud a 20°C. Si deben operar entre -10°C y 60°, ¿qué espacio debe dejarse como mínimo entre un tramo y el siguiente si se tienden a una temperatura de 20°? | |||
'''Dato:''' Coeficiente de dilatación lineal del acero: 13×10<sup>−6</sup>K<sup>−1</sup> | |||
[[Dilatación de raíles|Solución]] | |||
==Dilatación de tapa== | |||
Una forma de abrir un bote de vidrio cuya tapa metálica está demasiado apretada consiste en sumergirlo en un baño de agua caliente. Si sumergimos en agua a 60 °C un bote de 4.0 cm de radio con tapa de estaño que a 20 °C encaja perfectamente y el coeficiente de dilatación lineal del vidrio es <math>9\times 10^{-6}\mathrm{K}^{-1}</math> y el del estaño es <math>23\times 10^{-6}\mathrm{K}^{-1}</math>, ¿cuánta holgura queda al calentarlo? | |||
[[Dilatación de tapa|Solución]] | |||
==Cálculo de coeficientes== | |||
La densidad del agua, en kg/m³, para valores próximos a una presión de 15.0 MPa y una temperatura de 300℃ (estado del agua en una central nuclear) viene dada por la siguiente tabla: | |||
{| class="bordeado" style="margin:auto" | |||
|- | |||
| ρ (kg/m³) || T = 300 ℃ || T = 301 ℃ | |||
|- | |||
| p = 15.0 MPa || 725.55 || 723.46 | |||
|- | |||
| p = 15.1 MPa || 725.75 || 723.66 | |||
|} | |||
# ¿Cuánto vale, aproximadamente, el coeficiente de dilatación volumétrica, β, a 300℃ y 15.0 MPa? | |||
# ¿Cuánto vale, aproximadamente, el coeficiente de compresibilidad, <math>\kappa_T</math>, a 300℃ y 15.0 MPa? | |||
[[Cálculo de coeficientes|Solución]] | |||
==Compresión de un gas por una pesa== | |||
Un cilindro vertical de sección cuadrada (esto es, un prisma) de 4.0 cm de lado contiene hidrógeno a 27°C y 100 kPa de presión, que también es la temperatura y presión exterior. La tapa del cilindro puede deslizarse sin rozamiento e inicialmente se encuentra a 10.0 cm de altura. Se coloca sobre la tapa una pesa de 40 N. Halle la altura de la tapa una vez que se alcanza de nuevo el equilibrio térmico con el exterior. ¿A qué temperatura habrá que calentar el gas para que la tapa vuelva a su posición inicial, con el peso todavía encima? | |||
[[Compresión de un gas por una pesa|Solución]] | |||
==Termómetro con dos cámaras de gas== | |||
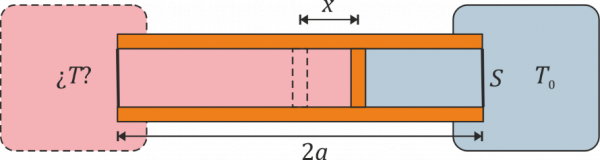
Se construye un termómetro de gas ideal según el siguiente principio: un tubo cilíndrico de sección <math>S</math> y longitud <math>2a</math> con paredes adiabáticas y bases diatermas es dividido por un pistón, también adiabático, que puede deslizarse sin rozamiento por el interior del tubo. En el interior de las dos cámaras se encuentra un gas ideal. Una de las dos cámaras se mantiene en contacto térmico con un foco a temperatura <math>T_0</math>, mientras que la otra se pone en contacto con el sistema cuya temperatura se quiere medir. Cuando las dos temperaturas son iguales el pistón se encuentra en la posición central y la presión del gas es <math>p_0</math>. | |||
# Calcule la temperatura absoluta <math>T</math> a la que se encuentra el sistema cuando el pistón se ha desplazado una cantidad <math>x</math> desde el centro hacia el sistema a <math>T_0</math>. ¿Resulta una escala lineal de temperaturas? ¿A cuánto tiende <math>x</math> si <math>T\to 0</math> o si <math>T\to\infty</math>? | |||
# Supongamos que el tubo mide 20 cm, la temperatura de referencia es <math>T_0 = 300\,\mathrm{K}</math> y el pistón se desplaza 1 cm. ¿Cuál es la temperatura del sistema exterior? | |||
<center>[[Archivo:Termometro_con_dos_camaras.png|600px]]</center> | |||
[[Termómetro con dos cámaras de gas|Solución]] | |||
==Equivalencia de un psi== | |||
Una atmósfera equivale a 101325 Pa. Un psi es la presión ejercida por una libra (4.448 N) sobre un cuadrado de lado 1 pulgada (2.54 cm). ¿A cuántos psi equivale una atmósfera? | |||
[[Equivalencia de un psi|Solución]] | |||
==Equivalencia de una atmósfera técnica== | |||
Una atmósfera técnica (at) es la presión ejercida por el peso de un kilogramo sobre una superficie de 1 cm². ¿A cuántos pascales equivale 1 at? ¿Y cuántas atmósferas estándar, atm? ¿Y cuantos psi? | |||
[[Equivalencia de una atmósfera técnica|Solución]] | |||
==Tubo con cámaras con hidrógeno y nitrógeno== | |||
Se tiene una cámara cilíndrica horizontal de 100 cm² de sección y 60 cm de longitud de paredes rígidas no aisladas térmicamente. En el punto medio del tubo se encuentra un émbolo (de espesor despreciable) que puede desplazarse, aunque inicialmente está fijado con pernos. En la cámara de la izquierda hay 2.8 g de H<sub>2</sub> gaseoso y en la de la derecha 2.8 g de N<sub>2</sub>. Los dos gases y el ambiente que los rodea están a 27°C. | |||
# Halle la fuerza que los gases producen sobre el émbolo cuando éste se encuentra en la posición central. | |||
# Determine la posición final del émbolo una vez que se liberan los pernos, suponiendo que todas las superficies son diatermas | |||
[[Tubo con cámaras con hidrógeno y nitrógeno|Solución]] | |||
==Dos cámaras inicialmente aisladas== | |||
Dos cámaras A y B con el mismo volumen de aire están separadas por un émbolo que puede moverse libremente. Las paredes y el émbolo están aislados térmicamente. Inicialmente las dos cámaras están en equilibrio. Se retira el aislante del émbolo. Una vez que se vuelve a alcanzar el equilibrio, el volumen de A es el doble que el de B. | |||
[[Archivo:Dos-camaras-aisladas.png|center]] | |||
# Antes de que se retirara el aislante, ¿qué proporción había entre las temperaturas de A y B? | |||
# Una vez que se ha alcanzado de nuevo el equilibrio, ¿qué proporción hay entre las densidades de masa del aire de ambas cámaras? | |||
[[Dos cámaras inicialmente aisladas|Solución]] | |||
==Compresión lineal de un gas== | |||
Se comprime cuasiestáticamente un gas ideal que inicialmente se encuentra a presión <math>p_A = 100\,\mathrm{kPa}</math>, temperatura <math>T_A = 300\,\mathrm{K}</math> y | |||
ocupa un volumen <math>V_A = 0.01\,\mathrm{m}^3</math>, según la ley | |||
<center><math>p=3p_A-\frac{2p_A}{V_A}V</math></center> | |||
La compresión continúa hasta que la presión vale <math>p_B = 2p_A</math>. | |||
# Calcule la temperatura final del gas. ¿Es este un proceso isotermo? | |||
# Trace la curva que describe el proceso en un diagrama pV. | |||
# ¿Cuál es la temperatura máxima que alcanza el gas? ¿En qué estado la alcanza? | |||
[[Compresión lineal de un gas|Solución]] | |||
==Expansión lineal de un gas== | |||
Se tiene un volumen de 1 m³ de un gas ideal diatómico, a 100 kPa y 300 K. Sobre este gas se realiza un proceso cuasiestático en el que se aumenta gradualmente su presión y volumen de forma que en todo momento su presión es proporcional al volumen ocupado. Al final del proceso, el volumen del gas es de 3 m³. ¿Cuál es la temperatura final del gas? | |||
[[Expansión lineal de un gas|Solución]] | |||
==Modelo de atmósfera isoterma== | |||
En el modelo de la atmósfera isoterma (en el que se supone que toda la troposfera está a la misma temperatura), la presión disminuye con la altura como | |||
<center><math>p=p_0 \mathrm{e}^{-\alpha z}</math></center> | |||
donde <math>z</math> es la altura sobre el nivel del mar y <math>p_0=101325\,\mathrm{Pa}</math>. Se sabe que, en el aeropuerto de El Alto, en La Paz (Bolivia), que se encuentra a 4061 m de altitud, la presión atmosférica vale 62611 Pa. También se sabe que la densidad del aire a nivel del mar vale <math>\rho_0=1.225\,\mathrm{kg}/\mathrm{m}^3</math>. | |||
# ¿Cuánto vale la densidad del aire en el aeropuerto de El Alto? | |||
# ¿Cuánto vale la presión atmosférica en lo alto del Everest (8848 m)? | |||
# La tabla adjunta da la temperatura de saturación del agua a diferentes presiones. | |||
| |||
{| class="bordeado" | |||
|- | |||
| <math>p (\mathrm{kPa})</math> | |||
| 15 || 20 || 25 || 30 || 35 || 40 | |||
|- | |||
| <math>T_\mathrm{sat} (\mathrm{K})</math> | |||
| 327.12 || 333.21 || 338.11 || 342.25 || 345.83 || 349.01 | |||
|- | |||
| <math>p (\mathrm{kPa})</math> | |||
| 45 || 50 || 55 || 60 || 65 || 70 | |||
|- | |||
| <math>T_\mathrm{sat} (\mathrm{K})</math> | |||
| 351.86 || 354.47 || 356.86 || 359.08 || 361.14 || 363.08 | |||
|- | |||
| <math>p (\mathrm{kPa})</math> | |||
| 75 || 80 || 85 || 90 || 95 || 100 | |||
|- | |||
| <math>T_\mathrm{sat} (\mathrm{K})</math> | |||
| 364.91 || 366.64 || 368.28 || 369.84 || 371.33 || 372.76 | |||
|} | |||
| |||
: ¿A qué temperatura hierve el agua en el aeropuerto de El Alto? ¿Y en el Everest? | |||
[[Modelo de atmósfera isoterma|Solución]] | |||
==Calidad de una mezcla== | |||
La densidad del agua a 101.3 kPa y 100 ℃ es de 958 kg/m³ y la del vapor de agua a la misma temperatura y presión es de 0.59 kg/m³. Se tiene 1000 cm³ de agua a 100℃ en un cilindro con pistón móvil. Se suministra calor al agua de forma que se vaporiza parcialmente. Halle la calidad (o título) de la mezcla de agua y vapor de agua en el estado final, si el volumen final es | |||
# 2 L | |||
# 1 m³. | |||
[[Calidad de una mezcla|Solución]] | |||
==Coeficientes de un gas ideal== | |||
Calcule el coeficiente de dilatación y el coeficiente de compresibilidad isoterma de un gas ideal a 300 K y 100 kPa. | |||
[[Coeficientes de un gas ideal|Solución]] | |||
Revisión del 15:05 18 feb 2024
Conversión entre escalas de temperaturas
Exprese las siguientes temperaturas en la escala Celsius, absoluta y Fahrenheit:
- Cero absoluto
- 0°F
- 100°F
- Punto triple del agua
- Punto de fusión del azufre a 1 atm
- Punto de sublimación del hielo seco a 1 atm
Nueva escala de temperatura
Zorg, un habitante de Titán, construye una escala de temperaturas basada en el metano tal que a la fusión (91 K) le corresponden 0 °Z y a la ebullición (116 K) 100 °Z. ¿Cuál es la temperatura del cero absoluto en esta escala?
Fahrenheit 451
El título de la novela de Ray Bradbury “Fahrenheit 451” se refiere a la temperatura a la que arde el papel. Si 32°F son 0℃ y 212 °F son 100℃, ¿cómo se titularía esta novela en la escala absoluta?
Aire en una habitación
Estime la masa de aire en el aula 310 de la ETSI (a) Un día de enero a las 5 de la madrugada. (b) Un día de julio a las 4 de la tarde. Razone las aproximaciones efectuadas.
Dilatación de una esfera metálica
Se tiene una bola hueca de hierro que a 20°C tiene un radio interior de 12.0 mm y un radio exterior de 15.0 mm, siendo la densidad del hierro a esta temperatura 7874 kg/m³ y su coeficiente de dilatación lineal 11.8×10−6K−1.
Se eleva la temperatura de la bola a 50°C. Determine:
- Los nuevos radios interior y exterior de la bola.
- El incremento en el volumen ocupado por el hierro.
- La variación en la densidad del hierro
Dilatación de raíles
Los raíles ferroviarios son de acero y tienen 18 m de longitud a 20°C. Si deben operar entre -10°C y 60°, ¿qué espacio debe dejarse como mínimo entre un tramo y el siguiente si se tienden a una temperatura de 20°?
Dato: Coeficiente de dilatación lineal del acero: 13×10−6K−1
Dilatación de tapa
Una forma de abrir un bote de vidrio cuya tapa metálica está demasiado apretada consiste en sumergirlo en un baño de agua caliente. Si sumergimos en agua a 60 °C un bote de 4.0 cm de radio con tapa de estaño que a 20 °C encaja perfectamente y el coeficiente de dilatación lineal del vidrio es y el del estaño es , ¿cuánta holgura queda al calentarlo?
Cálculo de coeficientes
La densidad del agua, en kg/m³, para valores próximos a una presión de 15.0 MPa y una temperatura de 300℃ (estado del agua en una central nuclear) viene dada por la siguiente tabla:
| ρ (kg/m³) | T = 300 ℃ | T = 301 ℃ |
| p = 15.0 MPa | 725.55 | 723.46 |
| p = 15.1 MPa | 725.75 | 723.66 |
- ¿Cuánto vale, aproximadamente, el coeficiente de dilatación volumétrica, β, a 300℃ y 15.0 MPa?
- ¿Cuánto vale, aproximadamente, el coeficiente de compresibilidad, , a 300℃ y 15.0 MPa?
Compresión de un gas por una pesa
Un cilindro vertical de sección cuadrada (esto es, un prisma) de 4.0 cm de lado contiene hidrógeno a 27°C y 100 kPa de presión, que también es la temperatura y presión exterior. La tapa del cilindro puede deslizarse sin rozamiento e inicialmente se encuentra a 10.0 cm de altura. Se coloca sobre la tapa una pesa de 40 N. Halle la altura de la tapa una vez que se alcanza de nuevo el equilibrio térmico con el exterior. ¿A qué temperatura habrá que calentar el gas para que la tapa vuelva a su posición inicial, con el peso todavía encima?
Termómetro con dos cámaras de gas
Se construye un termómetro de gas ideal según el siguiente principio: un tubo cilíndrico de sección y longitud con paredes adiabáticas y bases diatermas es dividido por un pistón, también adiabático, que puede deslizarse sin rozamiento por el interior del tubo. En el interior de las dos cámaras se encuentra un gas ideal. Una de las dos cámaras se mantiene en contacto térmico con un foco a temperatura , mientras que la otra se pone en contacto con el sistema cuya temperatura se quiere medir. Cuando las dos temperaturas son iguales el pistón se encuentra en la posición central y la presión del gas es .
- Calcule la temperatura absoluta a la que se encuentra el sistema cuando el pistón se ha desplazado una cantidad desde el centro hacia el sistema a . ¿Resulta una escala lineal de temperaturas? ¿A cuánto tiende si o si ?
- Supongamos que el tubo mide 20 cm, la temperatura de referencia es y el pistón se desplaza 1 cm. ¿Cuál es la temperatura del sistema exterior?
Equivalencia de un psi
Una atmósfera equivale a 101325 Pa. Un psi es la presión ejercida por una libra (4.448 N) sobre un cuadrado de lado 1 pulgada (2.54 cm). ¿A cuántos psi equivale una atmósfera?
Equivalencia de una atmósfera técnica
Una atmósfera técnica (at) es la presión ejercida por el peso de un kilogramo sobre una superficie de 1 cm². ¿A cuántos pascales equivale 1 at? ¿Y cuántas atmósferas estándar, atm? ¿Y cuantos psi?
Tubo con cámaras con hidrógeno y nitrógeno
Se tiene una cámara cilíndrica horizontal de 100 cm² de sección y 60 cm de longitud de paredes rígidas no aisladas térmicamente. En el punto medio del tubo se encuentra un émbolo (de espesor despreciable) que puede desplazarse, aunque inicialmente está fijado con pernos. En la cámara de la izquierda hay 2.8 g de H2 gaseoso y en la de la derecha 2.8 g de N2. Los dos gases y el ambiente que los rodea están a 27°C.
- Halle la fuerza que los gases producen sobre el émbolo cuando éste se encuentra en la posición central.
- Determine la posición final del émbolo una vez que se liberan los pernos, suponiendo que todas las superficies son diatermas
Dos cámaras inicialmente aisladas
Dos cámaras A y B con el mismo volumen de aire están separadas por un émbolo que puede moverse libremente. Las paredes y el émbolo están aislados térmicamente. Inicialmente las dos cámaras están en equilibrio. Se retira el aislante del émbolo. Una vez que se vuelve a alcanzar el equilibrio, el volumen de A es el doble que el de B.
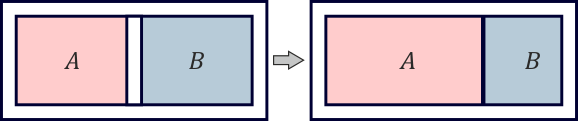
- Antes de que se retirara el aislante, ¿qué proporción había entre las temperaturas de A y B?
- Una vez que se ha alcanzado de nuevo el equilibrio, ¿qué proporción hay entre las densidades de masa del aire de ambas cámaras?
Compresión lineal de un gas
Se comprime cuasiestáticamente un gas ideal que inicialmente se encuentra a presión , temperatura y ocupa un volumen , según la ley
La compresión continúa hasta que la presión vale .
- Calcule la temperatura final del gas. ¿Es este un proceso isotermo?
- Trace la curva que describe el proceso en un diagrama pV.
- ¿Cuál es la temperatura máxima que alcanza el gas? ¿En qué estado la alcanza?
Expansión lineal de un gas
Se tiene un volumen de 1 m³ de un gas ideal diatómico, a 100 kPa y 300 K. Sobre este gas se realiza un proceso cuasiestático en el que se aumenta gradualmente su presión y volumen de forma que en todo momento su presión es proporcional al volumen ocupado. Al final del proceso, el volumen del gas es de 3 m³. ¿Cuál es la temperatura final del gas?
Modelo de atmósfera isoterma
En el modelo de la atmósfera isoterma (en el que se supone que toda la troposfera está a la misma temperatura), la presión disminuye con la altura como
donde es la altura sobre el nivel del mar y . Se sabe que, en el aeropuerto de El Alto, en La Paz (Bolivia), que se encuentra a 4061 m de altitud, la presión atmosférica vale 62611 Pa. También se sabe que la densidad del aire a nivel del mar vale .
- ¿Cuánto vale la densidad del aire en el aeropuerto de El Alto?
- ¿Cuánto vale la presión atmosférica en lo alto del Everest (8848 m)?
- La tabla adjunta da la temperatura de saturación del agua a diferentes presiones.
| 15 | 20 | 25 | 30 | 35 | 40 | |
| 327.12 | 333.21 | 338.11 | 342.25 | 345.83 | 349.01 | |
| 45 | 50 | 55 | 60 | 65 | 70 | |
| 351.86 | 354.47 | 356.86 | 359.08 | 361.14 | 363.08 | |
| 75 | 80 | 85 | 90 | 95 | 100 | |
| 364.91 | 366.64 | 368.28 | 369.84 | 371.33 | 372.76 |
- ¿A qué temperatura hierve el agua en el aeropuerto de El Alto? ¿Y en el Everest?
Calidad de una mezcla
La densidad del agua a 101.3 kPa y 100 ℃ es de 958 kg/m³ y la del vapor de agua a la misma temperatura y presión es de 0.59 kg/m³. Se tiene 1000 cm³ de agua a 100℃ en un cilindro con pistón móvil. Se suministra calor al agua de forma que se vaporiza parcialmente. Halle la calidad (o título) de la mezcla de agua y vapor de agua en el estado final, si el volumen final es
- 2 L
- 1 m³.
Coeficientes de un gas ideal
Calcule el coeficiente de dilatación y el coeficiente de compresibilidad isoterma de un gas ideal a 300 K y 100 kPa.






















