Enunciado
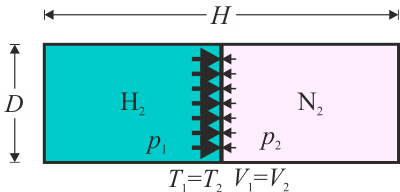
Se tiene una cámara cilíndrica horizontal de 100 cm² de sección y 60 cm de longitud de paredes rígidas no aisladas térmicamente. En el punto medio del tubo se encuentra un émbolo (de espesor despreciable) que puede desplazarse, aunque inicialmente está fijado con pernos. En la cámara de la izquierda hay 2.8 g de H2 gaseoso y en la de la derecha 2.8 g de N2. Los dos gases y el ambiente que los rodea están a 27°C.
- Halle la fuerza que los gases producen sobre el émbolo cuando éste se encuentra en la posición central.
- Determine la posición final del émbolo una vez que se liberan los pernos, suponiendo que todas las superficies son diatermas
Fuerza
Sea la longitud del tubo y su sección. El volumen cada gas es el mismo, la mitad del del cilindro
En lo que sigue mediremos la presión en kPa y el volumen en L, de manera que su producto cumple .
También son iguales sus temperaturas
Sus presiones, sin embargo, son diferentes. Aunque en las dos cámaras se encuentra la misma masa de gas, el número de moles es diferente. Obtenemos la cantidad de moles dividiendo por el peso molecular. Para el hidrógeno , que podemos aproximar simplemente por 2.0
y para el nitrógeno , que podemos aproximar simplemente por 28.0
Esto nos da la presión del hidrógeno
y la del nitrógeno
Vemos que la presión es mucho mayor en el lado del hidrógeno, por haber muchos más moles de este gas.
La fuerza sobre el émbolo la obtenemos a partir de la diferencia de presiones
Resulta una fuerza gigantesca, debida a la elevada diferencia de presiones entre los dos lados. Esta fuerza va dirigida desde el lado del hidrógeno, que está a mayor presión, hacia el del nitrógeno, donde es más reducida.
Posición de equilibrio
Si liberamos el pistón, este saldrá disparado (ya que se trata, en el fondo, de una pistola de aire comprimido), pero –suponiendo que no se rompa–, al expandirse el hidrógeno, se comprime el nitrógeno, con lo que la presión de uno disminuye y la del otro aumenta.
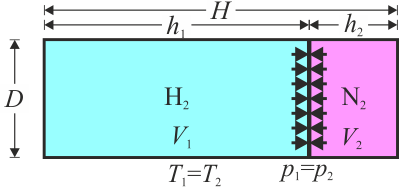
Cuando se alcanza de nuevo el equilibrio mecánico, las dos presiones son iguales, aunque no sabemos cuanto vale, por ahora,
y, puesto que el sistema tiene paredes diatermas, la temperatura de los dos gases será la misma e igual a la exterior
Tampoco conocemos el volumen de cada gas, pero sí que juntos nos dan el volumen total. Si y son las longitudes de cada cámara en la dirección del eje del cilindro
Nos queda entonces el sistema de ecuaciones
con la solución
Vemos que el hidrógeno se expande hasta ocupar casi todo el cilindro.

















