Diferencia entre revisiones de «Calor y trabajo en un proceso lineal»
(Página creada con «==Enunciado== Considere el caso del problema “Compresión lineal de un gas”, en el que se comprime cuasiestáticamente un gas ideal diatómico que inicialmente se encuentra a presión <math>p_A=100\,\mathrm{kPa}</math>, temperatura <math>T_A=300\,\mathrm{K}</math> y ocupa un volumen <math>V_A=0.01\,\mathrm{m}^3</math>, según la ley <center><math>p=3p_A-\frac{2p_A}{V_A} V</math></center> La compresión continúa hasta que la presión vale <math>p_B…») |
|||
| (No se muestra una edición intermedia del mismo usuario) | |||
| Línea 19: | Línea 19: | ||
<center><math>p_B=200\,\mathrm{kPa}\qquad V_B=5\,\mathrm{L}\qquad T_B=300\,\mathrm{K}</math></center> | <center><math>p_B=200\,\mathrm{kPa}\qquad V_B=5\,\mathrm{L}\qquad T_B=300\,\mathrm{K}</math></center> | ||
El proceso se describe mediante un | El proceso se describe mediante un segmento rectilíneo. El área bajo este segmento es el trabajo realizado, que será positivo por tratarse de una compresión. Podemos hallar este trabajo integrando | ||
<center><math>W=-\int_A^B p\,\mathrm{d}V = -\int_{10}^5 (300-20V)\mathrm{d}V = -\left | <center><math>W=-\int_A^B p\,\mathrm{d}V = -\int_{10}^5 (300-20V)\mathrm{d}V = -\left.\left(300V - 10 V^2\right)\right|_{10}^5= 750\,\mathrm{J}</math></center> | ||
o directamente empleando el área de un trapecio | o directamente empleando el área de un trapecio | ||
<center><math>W=\frac{p_A+p_B}{2}(V_A-V_B)=\frac{200+100}{2}(10-5)\,\mathrm{J}=750\,\mathrm{J}</math></center> | <center><math>W=\frac{p_A+p_B}{2}(V_A-V_B)=\frac{200+100}{2}(10-5)\,\mathrm{J}=750\,\mathrm{J}</math></center> | ||
<center>[[Archivo:calentamiento-lineal.png|600px]]</center> | |||
===Energía interna=== | ===Energía interna=== | ||
Revisión del 22:42 25 feb 2024
Enunciado
Considere el caso del problema “Compresión lineal de un gas”, en el que se comprime cuasiestáticamente un gas ideal diatómico que inicialmente se encuentra a presión , temperatura y ocupa un volumen , según la ley
La compresión continúa hasta que la presión vale .
- Calcule el trabajo neto realizado sobre el gas, la variación de su energía interna y el calor que entra en el gas durante el proceso.
- Separando el proceso en dos: uno hasta que alcanza la temperatura máxima y otro de ahí hasta el final, halle W, ΔU y Q en cada uno de los dos subprocesos.
Proceso completo
Trabajo
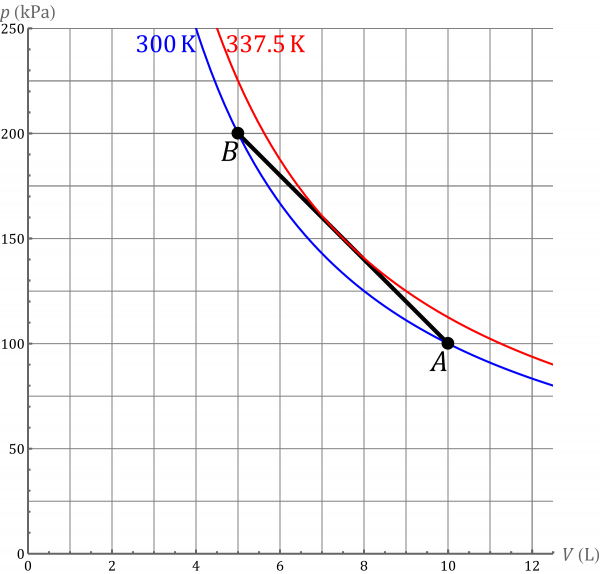
El proceso puede escribirse en forma numérica como
con el volumen en L y la presión en kPa. El estado inicial cumple
y el final, tal como se ve en el problema citado
El proceso se describe mediante un segmento rectilíneo. El área bajo este segmento es el trabajo realizado, que será positivo por tratarse de una compresión. Podemos hallar este trabajo integrando
o directamente empleando el área de un trapecio
Energía interna
La energía interna de un gas ideal depende solo de la temperatura. En este caso, la temperatura final en es la misma que la inicial, por lo que
Calor
Obtenemos el calor intercambiado empleando el primer principio de la termodinámica
División en dos tramos
Tal como se ve en el problema citado, la temperatura aumenta hasta un máximo y luego vuelve a disminuir. El máximo se alcanza cuando . Para este punto
Dividimos entonces el proceso en dos.
Primer tramo
Entre A y C el trabajo corresponde de nuevo al área de un trapecio:
La variación de energía ahora no es nula, pues la temperatura aumenta. Podemos hallar el cambio a partir de las presiones y volúmenes
lo que implica que en este tramo
Vemos que aunque la temperatura se eleva, el cambio se debe a la entrada de trabajo, no de calor.
Segundo tramo
Calculamos el trabajo de la misma manera
y la variación de la energía es ahora
En este tramo se pierde toda la energía ganada en el tramo anterior.
El calor es ahora
Todo el calor se expulsa en este segundo tramo.
Podíamos haber calculado estos valores simplemente restando los del primer tramo de los del proceso completo.



















