Diferencia entre revisiones de «Mezcla de dos cantidades de agua»
| (No se muestra una edición intermedia del mismo usuario) | |||
| Línea 52: | Línea 52: | ||
Gráficamente, tendríamos una representación como la de la figura | Gráficamente, tendríamos una representación como la de la figura | ||
<center>[[Archivo:Capacidad-calorifica-02.png]]</center> | <center>[[Archivo:Capacidad-calorifica-02.png|600px]]</center> | ||
la parte 1, que tiene más masa, posee una mayor capacidad calorífica, por lo que el aumento de temperatura, para una cantidad de calor dada, es menor que el descenso en la temperatura de la parte 2, que por ser más ligera tiene menos capacidad calorífica. La temperatura de equilibrio lo da el corte de las dos rectas y la cantidad de calor intercambiada es la abscisa de la gráfica. | la parte 1, que tiene más masa, posee una mayor capacidad calorífica, por lo que el aumento de temperatura, para una cantidad de calor dada, es menor que el descenso en la temperatura de la parte 2, que por ser más ligera tiene menos capacidad calorífica. La temperatura de equilibrio lo da el corte de las dos rectas y la cantidad de calor intercambiada es la abscisa de la gráfica. | ||
Revisión actual - 19:52 21 feb 2024
Enunciado
En un recipiente adiabático se ponen en contacto 750 cm³ de agua a 20℃ con 250 cm³ de agua a 80℃, siendo la temperatura exterior de 50°C. ¿Cuál es la temperatura final de la mezcla? ¿Cuánto calor entra en cada subsistema?
Solución
El recipiente está aislado térmicamente del exterior, por lo que la temperatura del ambiente es irrelevante. Tenemos un sistema aislado formado por las dos masas de agua. El único calor fluye de una parte del agua a la otra, pero no con el exterior. Si llamamos “1” al agua caliente originalmente y “2” a la fría, os queda la relación
o, dicho de otra forma
el calor que entra en el agua fría es igual al que sale de la caliente. Podemos escribir esto como
Por otro lado, el calor que entra en el agua fría es proporcional a la diferencia de temperaturas entre la final y la inicial
y el calor que entra en el agua caliente (que tendrá un valor negativo, porque en realidad sale) cumple la misma ley
El calor específico del agua, , depende poco de la temperatura, por lo que podemos suponer el mismo valor para las dos masas de agua.
Llevando esto al calor neto
y despejando obtenemos la temperatura final
Puesto que a este resultado se llega a partir de diferencias entre temperaturas es válido tanto para temperaturas expresadas en grados Celsius como en kelvins.
Para sustituir los valores numéricos observamos que se nos dan los volúmenes, no las masas. Sin embargo, puede suponerse que dentro del rango de temperaturas la densidad del agua permanece constante, por lo que
es decir, también se trata de la media ponderada respecto a los volúmenes. 3/4 l de agua cuentan el triple que 1/4 l. Sustituyendo los valores numéricos en grados Celsius
La cantidad de calor que va del agua caliente a la fría es
Al mismo resultado se llega, por supuesto, si en lugar del calor que entra en el medio 2, hallamos el que sale del medio 1
Gráficamente, tendríamos una representación como la de la figura
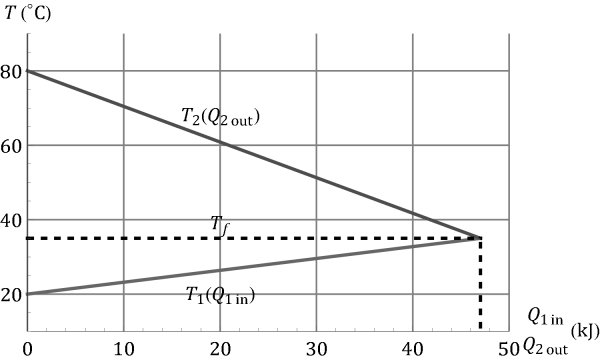
la parte 1, que tiene más masa, posee una mayor capacidad calorífica, por lo que el aumento de temperatura, para una cantidad de calor dada, es menor que el descenso en la temperatura de la parte 2, que por ser más ligera tiene menos capacidad calorífica. La temperatura de equilibrio lo da el corte de las dos rectas y la cantidad de calor intercambiada es la abscisa de la gráfica.











